Rejoignez-nous le 30 avril : dévoilement de Parasoft C/C++test CT pour l'excellence en matière de tests continus et de conformité | En savoir plus
Aller à la section
5 conseils pour l'analyse statique et dynamique dans les logiciels de dispositifs médicaux
L'analyse statique et dynamique est essentielle pour respecter la conformité dans les tests de logiciels, mais les processus ne sont pas faciles à mettre en œuvre. Le message fournit un guide expert sur la façon dont vous pouvez automatiser le processus.
Aller à la section
Aller à la section
La cybersécurité est une priorité importante de la FDA avec des exigences spécifiques concernant l'analyse de code statique et dynamique. Par conséquent, il est important que les ingénieurs automatisent ces pratiques et les intègrent dans les workflows de développement existants.
Pour les entreprises qui développent et fournissent des logiciels essentiels à la sûreté et à la sécurité pour les dispositifs médicaux, mettant en œuvre des pratiques d'analyse de code statiques et dynamiques et les déployant sur des projets allant de lecteurs de glycémie relativement simples à des systèmes plus complexes tels que des pompes à perfusion, des moniteurs patient et des poumons les unités de ventilation font partie intégrante du processus. Ce poste couvre analyse de code statique vs dynamique dans les logiciels de dispositifs médicaux et partage des conseils pratiques et des meilleures pratiques.
Introduction à l'analyse des risques des logiciels de dispositifs médicaux
Les dispositifs médicaux sont une partie essentielle du système de santé moderne. L'Organisation mondiale de la santé (OMS) estimations qu'il existe environ 2 millions de dispositifs médicaux dans le monde. Compte tenu de l'évolution de l'intelligence artificielle (IA), de l'apprentissage automatique (ML) et de l'Internet des objets (IoT), les dispositifs médicaux modernes sont devenus plus connectés que jamais, augmentant leur niveau de complexité et leurs cas d'utilisation.
Avec l'intégration croissante de la technologie dans la pratique médicale, les dispositifs médicaux s'appuient de plus en plus sur des logiciels pour exécuter certaines fonctions clés. Par exemple, les dispositifs médicaux peuvent faire des choses, comme analyser des images médicales et fournir une aide au diagnostic, déployer des implants intelligents avec des capteurs qui communiquent avec des appareils de bureau ou mobiles et effectuer des procédures chirurgicales robotisées, entre autres. Bien que les logiciels de dispositifs médicaux aient fait progresser le domaine de la médecine, ils nous laissent avec certains risques qui doivent être soigneusement gérés.
Les risques liés aux logiciels des dispositifs médicaux peuvent provenir de diverses sources, notamment des erreurs de codage, des dysfonctionnements matériels, des erreurs de l'utilisateur, etc. Ces risques peuvent potentiellement nuire aux patients, aux professionnels de la santé ou à toute personne entrant en contact avec l'appareil.
En plus des risques ci-dessus, des risques de cybersécurité entourent ces appareils lorsqu'ils collectent, stockent, traitent et transmettent des données médicales. Par conséquent, des organismes de réglementation comme la Food and Drug Administration (FDA) sont là pour réglementer la fabrication et le déploiement de logiciels de dispositifs médicaux. Cependant, pour savoir si votre logiciel de dispositif médical est conforme à ces normes réglementaires, il est indispensable de procéder à une analyse approfondie des risques logiciels du dispositif médical avant de les utiliser.
Qu'est-ce que l'analyse des risques des logiciels de dispositifs médicaux ?
Avant de discuter logiciel de dispositif médical l'analyse des risques, regardons le risque. Dans la définition la plus élémentaire, le risque est la possibilité de perte ou de blessure. L'analyse des risques des logiciels de dispositifs médicaux est le processus de test des logiciels de dispositifs médicaux pour identifier, évaluer et atténuer les risques qui leur sont associés. Cela implique également de tester l'utilisation prévue du logiciel, ses fonctionnalités et les dangers potentiels pour les patients ou les opérateurs à l'aide de certains critères de gestion des risques.
Pour les fabricants de dispositifs médicaux, l'analyse des risques est une composante essentielle du processus de développement de logiciels de dispositifs médicaux. Il s'agit d'une exigence essentielle qui aide les fabricants de dispositifs médicaux à respecter les normes réglementaires.
L'objectif principal de l'analyse des risques liés aux logiciels de dispositifs médicaux est de s'assurer que le logiciel est sûr et efficace, non seulement pour un usage médical, mais également de s'assurer que ces dispositifs ne sont pas sensibles aux cyberattaques et n'entraînent pas une violation importante des données.
Pourquoi l'analyse des risques des logiciels de dispositifs médicaux est-elle importante ?
Imaginez mettre une voiture sur la route sans vérifier certaines des pièces critiques comme le système de freinage, l'airbag, les feux, la suspension et les systèmes de direction. Ignorer ces contrôles pourrait augmenter la probabilité d'avoir un accident de voiture. Il en va de même pour le déploiement d'un logiciel de dispositif médical sans le soumettre à une analyse de risque.
L'analyse des risques des logiciels de dispositifs médicaux est cruciale pour assurer la sécurité des patients et réduire l'occurrence potentielle de risques médicaux et d'atteintes à la sécurité dans les dossiers médicaux des patients.
En outre, les organismes de réglementation tels que la FDA exigent que les fabricants de dispositifs médicaux effectuent une analyse des risques sur leur logiciel de dispositif médical avant qu'il ne puisse être approuvé pour une utilisation par les consommateurs. Le non-respect des exigences réglementaires peut entraîner des retards dans l'approbation des appareils ou entraîner des rappels.
En d'autres termes, l'analyse des risques peut également aider les fabricants à identifier les opportunités d'amélioration de la sûreté, de la sécurité et de la convivialité des appareils, ce qui pourrait entraîner une augmentation des ventes et de la part de marché.
Le cadre réglementaire pour l'analyse des risques des logiciels de dispositifs médicaux
Le développement de logiciels pour dispositifs médicaux est réglementé par divers organismes de réglementation tels que la FDA et le règlement européen sur les dispositifs médicaux (MDR).
En tant qu'agence de réglementation, la FDA garantit la sécurité, l'efficacité et la sécurité des médicaments à usage humain et vétérinaire, des produits biologiques, des dispositifs médicaux, des denrées alimentaires, des cosmétiques et d'autres produits. La mission de la FDA est de protéger et de promouvoir la santé publique en réglementant et en supervisant le développement, la fabrication, la commercialisation et la distribution de ces produits.
De même, ISO 13485 est une norme mondialement reconnue qui décrit les exigences de qualité dans l'industrie des dispositifs médicaux. Cette norme propose des directives pratiques aux fabricants pour mettre en œuvre des pratiques commerciales et techniques afin de garantir que tous les dispositifs médicaux sont conformes à la réglementation et aux besoins des clients.
En adoptant les meilleures pratiques et processus décrits dans la norme ISO 13485, les fabricants peuvent rationaliser leurs opérations, réduire les coûts, gérer les risques, augmenter la productivité et améliorer continuellement leurs produits et services.
Il existe également la CEI 62304, qui est un ensemble de normes internationales qui fournit des lignes directrices pour le développement, la maintenance et la gestion des risques des logiciels de dispositifs médicaux. Le cadre décrit les exigences qui doivent être respectées pour garantir que les logiciels utilisés dans les dispositifs médicaux sont sûrs, fiables et conformes aux normes acceptables. La CEI 62304 spécifie les processus de développement de logiciels, procédures de vérification et de validation des exigences documentaires.
Ces cadres réglementaires sont conçus pour servir de normes pour la réalisation d'analyses de risques sur les dispositifs médicaux. Par conséquent, leur respect est essentiel pour obtenir l'approbation réglementaire pour le développement de logiciels pour dispositifs médicaux et pour démontrer l'engagement d'un fabricant envers l'excellence et sa capacité à fournir des produits de haute qualité.
Pour que les fabricants de logiciels de dispositifs médicaux se conforment à ces réglementations, les processus de test de logiciels sont souvent nécessaires pour vérifier les erreurs de programmation, les violations de normes de codage, les violations de syntaxe, les configurations non sécurisées, etc. C'est ici que analyse de code statique et analyse dynamique entrez.
Analyse de code statique
L'analyse statique est une pratique de vérifier automatiquement la conformité aux directives de codage bien connues (MISRA, CERT, AUTOSAR, JSF) et de détecter les bogues potentiels tels que le déréférencement de pointeur nul, la division par zéro et les débordements de tampon. Les outils d'analyse statique modernes complètent également la pratique traditionnelle de revue de code en réduisant l'effort manuel d'au moins 30 %.
Dans la plupart des cas, la première exécution d'un outil d'analyse statique par rapport à votre code actuel affichera des milliers d'erreurs. Certaines équipes de développement de dispositifs médicaux ont même rencontré plus de 20,000 XNUMX lors du premier essai. Cela peut être incroyablement accablant. Il semble qu'il faudrait des années pour les réparer tous. Voici quelques conseils d'experts pour faire face au problème.
Conseil n° 1 : le compilateur est votre ami
Les équipes de développement disciplinées compilent généralement avec –Wall et –Werror (dans GCC), ou /Wall /WX (dans Visual Studio) ou en utilisant des options similaires dans d'autres compilateurs. La correction des avertissements du compilateur est un moyen simple et peu coûteux de se préparer à l'exécution de l'analyse statique. L'examen de la sortie de votre compilateur en mode "paranoïaque" peut réduire le volume global de violations d'analyse statique.
Bien qu'avoir corrigé tous les avertissements du compilateur soit une bonne chose, il existe de nombreux projets où l'utilisation d'un seul compilateur ne suffira pas et n'est pas une option acceptable pour des raisons de conformité.
Après avoir vidé votre compilateur à sec, utilisez des outils d'analyse statique destinés à approfondir le code et à vous donner beaucoup plus d'indices.
Astuce #2 : Adoptez l'analyse statique tôt dans le processus
Si vous développez actuellement un logiciel pour dispositif médical, vous devez être prêt à répondre à la question d'un pratique d'analyse automatisée de code statique. L'analyse statique est presque garantie d'être un sujet de discussion lors d'un audit interne/externe ou même d'une soumission avant commercialisation.
La clé est de déployer l'outil de manière à ce que le développement ne perde pas de vitesse tout en se concentrant sur l'amélioration de la qualité, et n'ait pas à gérer les idiosyncrasies et le bruit de l'outil. Il s'agit d'un exercice d'équilibre, nécessitant de la pratique et de l'expertise. Ce que vous pourriez découvrir, c'est qu'en découvrant la cause première des erreurs signalées, vous découvrirez probablement que nombre d'entre elles sont faciles à corriger.
Voici quelques exemples de rapport d'analyse statique faciles à corriger avec un simple script ou des stagiaires bien formés.
- Appel de fonctions claires dans les destructeurs.
- Le destructeur '~CTitle' ne doit pas appeler la fonction 'clear_' qui n'est pas dans le contexte try
- Le destructeur '~THelper' ne doit pas appeler la fonction 'removeModule' qui n'est pas dans le contexte try
- Vérifiez NULL.
- "pMP" peut éventuellement être nul
- "((NPage*)this)->pSysCfg_" peut éventuellement être nul
- Peut-être déclaration dans la mauvaise section.
- Les membres de données 'D_FILE_1' sont déclarés comme 'public'
- Arguments non constants.
- Le littéral de chaîne "MCollection" est passé à la fonction "FixedBlockHeap" en tant que pointeur vers un objet non constant
De nombreuses violations du code existant que vous pouvez mettre de côté et les traiter lorsque vous avez des temps d'arrêt. Cependant, il est important de NE PAS introduire de nouvelles violations, appelées dette technique, lorsque vous développez du code. Par exemple, Parasoft C / C ++test possède des fonctionnalités qui permettent aux ingénieurs de filtrer le bruit et de se concentrer sur la résolution des violations récentes de l'analyse statique les plus critiques.
Analyse dynamique
Alors que l'analyse statique interprète le code source comme du texte et tire toutes les conclusions basées sur la sortie de l'analyseur sans exécuter une seule instruction, test dynamique de sécurité des applications ou DAST offre une perspective différente sur le code. Il examine le code en cours d'exécution, montrant la couverture du code, la suffisance et la qualité des tests unitaires, les fuites de mémoire et d'autres problèmes de faiblesse potentiels.
Conseil n° 3 : Soyez flexible avec votre environnement d'exécution
Le terme "intégré" couvre de nombreux appareils, du MCU 8 bits avec des kilo-octets de RAM et du flash au processeur multicœur 64 bits avec des giga-octets de RAM et un SSD haute vitesse. Dans le cas où le fonctionnement quotidien de l'appareil nécessite une mémoire et une puissance de traitement minimales, les fabricants sont susceptibles d'opter pour du matériel adapté uniquement à ses besoins, en tenant compte des contraintes de taille, de poids ou de coût.
Bien qu'ils laissent généralement une certaine capacité pour les mises à jour logicielles et la maintenance, cela peut encore être insuffisant en ce qui concerne l'outil d'analyse dynamique instrumentant le logiciel, car le processus nécessitera une énorme quantité de RAM par rapport au mode de fonctionnement normal et un espace de stockage pour collecter le test. et les résultats de couverture de code.
Par conséquent, lorsque la quantité de mémoire sur l'appareil est trop faible pour exécuter des tests et collecter la couverture de code, la plate-forme cible peut ne pas convenir à la collecte de la couverture de code pour les tests unitaires et d'intégration.
Si votre plate-forme cible principale n'est pas prise en charge par défaut, recherchez des alternatives valides. Il pourrait y avoir une plate-forme sœur avec plus d'interfaces et de mémoire prise en charge par un outil d'analyse dynamique afin que vous puissiez l'utiliser pour les tests unitaires et certains tests d'intégration. Une autre alternative consiste à utiliser des simulateurs matériels, qui exécutent ARM Fast Models et QEMU.
Bien que l'exécution de tests sur la plate-forme cible soit la plus souhaitable, de nombreuses équipes choisissent souvent d'effectuer des tests unitaires et certains tests d'intégration d'applications sur le poste de travail du développeur, tels que Linux, Mac, Windows, pour bénéficier d'un cycle de développement plus rapide et d'un plus grand nombre d'outils. disponible pour les plates-formes de développement générales. Dans ce cas, vous devrez porter votre code intégré pour le compiler avec un compilateur hôte, ce qui peut présenter des difficultés.
Il existe de nombreux compilateurs, outils de construction, frameworks et méthodes pour les exécuter. Les outils d'analyse dynamique prennent en charge certaines techniques de construction courantes avec des présomptions internes sur la façon dont les développeurs peuvent les appliquer. Par conséquent, même si le code est portable, l'équipe de projet aura probablement besoin de plus de temps pour aligner les paramètres d'un outil d'analyse dynamique en fonction du fonctionnement du système de génération du projet.
Il est fortement recommandé d'estimer à l'avance tous les efforts afin de choisir la meilleure approche pour le développement futur et le soutien dans une perspective à long terme.
Conseil n ° 4: Ne vous fiez pas trop aux cas de test générés automatiquement
Les outils d'analyse dynamique modernes génèrent automatiquement des ensembles de tests unitaires pour augmenter la couverture du code. Mais les outils ne sont que des outils. Ils sont agnostiques quant à divers scénarios d'utilisation du code de production, en particulier lorsque vous essayez d'augmenter la couverture du code et de franchir une frontière entre les tests unitaires purs et les tests d'intégration. Vous devrez toujours mettre à jour manuellement les tests unitaires générés et même en écrire de nouveaux, car vous seul savez ce que le code est censé faire en ce qui concerne les résultats de test positifs et négatifs.
Un ensemble de fichiers sélectionnés dans une zone critique peut avoir des tests unitaires générés automatiquement couverts dans une plage allant de 40 % à 100 % pour chaque fichier. Mais en moyenne, pour l'ensemble du projet, les chiffres peuvent varier de 25 % à 60 %.
De plus, les tests unitaires générés automatiquement en utilisant uniquement le code source comme entrée peuvent souvent fonctionner parfaitement sur du code bogué. La génération automatique doit être utilisée comme un bon moyen de démarrer le processus de test unitaire. Le processus de création manuelle de scénarios de test améliore la qualité du code car il oblige à une révision supplémentaire du code et offre un point de vue différent sur la conception.
Conseil n° 5 : Ne sous-estimez pas l'effort de qualification et de validation des outils
La FDA exige que tout outil utilisé lors du développement formel soit validé pour l'utilisation prévue afin de s'assurer qu'il exécute les actions attendues et produit les bons résultats. Habituellement, il s'agit d'un protocole de test spécial appelé IUV (validation de l'utilisation prévue).
Les principaux fournisseurs d'outils d'analyse statique et dynamique de l'industrie aident à produire les procédures et la documentation nécessaires, ce qui est extrêmement utile pour minimiser vos efforts. Les solutions de Parasoft sont particulièrement précieuses car elles automatisent une grande partie du processus. Comme pour tout autre package générique, vous souhaiterez peut-être réserver une partie de vos efforts à la révision et à l'ajustement des documents afin de les synchroniser avec vos propres procédures QMS. Par exemple, le Tool Qualification Kit de Parasoft fournit un ensemble de cas de test à exécuter sur votre environnement pour valider les capacités d'analyse statique et dynamique.
Récapitulatif des 5 conseils
Traitez les avertissements du compilateur comme des erreurs. Les avertissements peuvent devenir des erreurs plus tard pour la version la plus récente du même compilateur. Les avertissements signifient souvent que le compilateur fait quelque chose de manière implicite.
- Exécutez les outils d'analyse statique au début du projet et résolvez les problèmes au fur et à mesure qu'ils apparaissent.
- Gardez le code portable. Même si vous ne prévoyez pas de porter votre produit sur une autre plate-forme, cela pourrait être une option à l'avenir. D'un autre côté, cela aidera également à garder votre code propre, maintenable et lisible, ce qui est toujours bon pour la révision et le soutien supplémentaire.
- Ne vous fiez pas trop aux cas de test générés automatiquement pour améliorer la qualité du code.
- Ne sous-estimez pas la nécessité et l'effort de valider l'outil pour son utilisation prévue.
Gestion des risques dans le développement de logiciels pour dispositifs médicaux
Lors du développement de logiciels pour dispositifs médicaux, la gestion des risques est un élément essentiel du processus. Les logiciels de dispositifs médicaux sont souvent complexes et doivent fonctionner selon des critères de référence stricts pour garantir la sûreté, la sécurité et l'efficacité des dispositifs médicaux. Par conséquent, il est essentiel d'identifier, d'analyser et d'atténuer les risques potentiels qui pourraient survenir au cours du processus de développement.
- La gestion efficace des risques dans le développement de logiciels pour dispositifs médicaux implique un certain nombre d'activités différentes. Ceux-ci pourraient inclure :
- Identifier les dangers et les risques potentiels associés à l'appareil et à son logiciel.
- Évaluer la probabilité et la gravité des risques.
- Mettre en œuvre des contrôles des risques pour atténuer ou éliminer les risques.
- Suivi de l'efficacité de ces contrôles dans le temps.
En outre, la gestion des risques dans le développement de logiciels pour dispositifs médicaux nécessite également une compréhension approfondie du niveau de préjudice qu'un défaut de logiciel médical peut causer. Cela peut être fait grâce à l'indexation des risques, qui catégorise les risques en fonction de leur niveau de gravité.
Dans le contexte des logiciels de dispositifs médicaux, l'établissement d'un indice de risque aide à déterminer les indicateurs de gestion des risques, tels que le niveau requis de test, de vérification et de validation qui doit être effectué sur le logiciel avant sa mise en service. Cela peut également aider à donner le ton pour les tests, la surveillance et la maintenance continus qui peuvent être nécessaires pour garantir la sécurité et l'efficacité continues du logiciel.
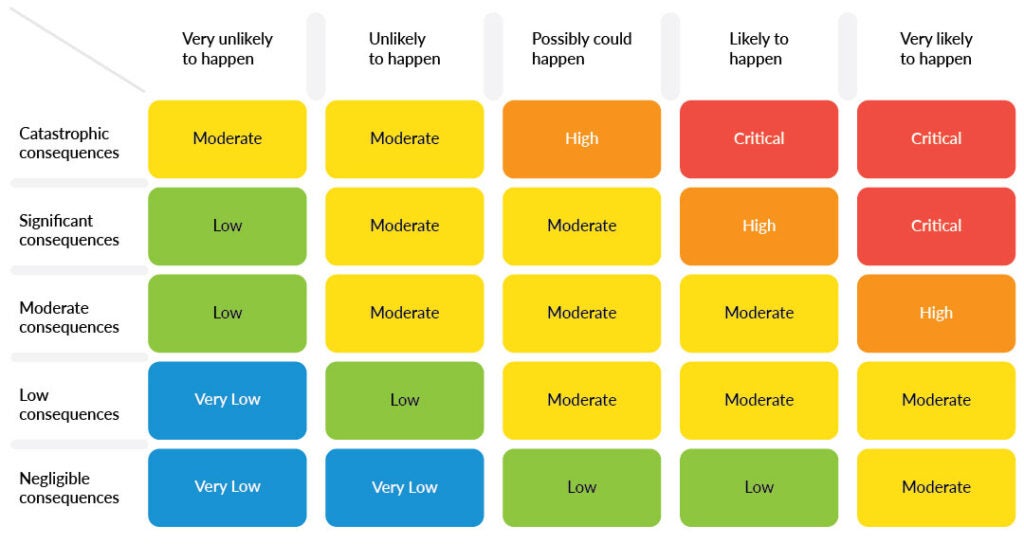
L'importance de la gestion des risques dans le développement de logiciels pour dispositifs médicaux
Une gestion efficace des risques est essentielle dans le développement de logiciels pour dispositifs médicaux. Même des erreurs ou des oublis mineurs peuvent avoir de graves conséquences pour les patients du secteur de la santé. Par conséquent, il est essentiel d'identifier et d'atténuer les risques potentiels le plus tôt possible dans le processus de développement.
Voici quelques-unes des raisons pour lesquelles la gestion des risques est importante dans le développement de logiciels pour dispositifs médicaux :
- Assure la sécurité des patients. Les défaillances logicielles des dispositifs médicaux peuvent entraîner des risques pour la santé. Une gestion efficace des risques permet d'identifier les risques potentiels et de les atténuer avant qu'ils ne nuisent aux patients.
- Assure la conformité réglementaire. Le développement de logiciels pour dispositifs médicaux est soumis aux exigences réglementaires fixées par des organismes de réglementation tels que la FDA et le MDR de l'UE. Le respect de ces réglementations est essentiel pour éviter les sanctions et réduire la probabilité de rappel de produits. Cela peut également éviter aux fabricants de dispositifs médicaux d'être tenus responsables de tout dommage causé par leurs produits, leur évitant ainsi des conséquences juridiques et financières.
- Économise du temps et de l'argent. Une gestion efficace des risques peut aider à réduire le temps et le coût de traitement des problèmes liés aux produits et des actions en justice. L'identification des risques au début du cycle de vie du développement logiciel peut éviter que des problèmes ne surviennent plus tard et éviter des retards dans la mise sur le marché des produits.
- Augmente la réputation. Aucun fabricant de dispositifs médicaux ne voudrait risquer d'avoir une mauvaise réputation, car une réputation entachée peut affecter les chances de succès. Une gestion efficace des risques aide à démontrer que le fabricant s'engage à assurer la sécurité des patients et la qualité des produits, ce qui peut améliorer la réputation d'une entreprise.
Éléments clés de la gestion des risques dans le développement de logiciels pour dispositifs médicaux
La gestion des risques dans le développement de logiciels pour dispositifs médicaux peut être compliquée. Cependant, certains éléments clés peuvent servir de guide aux développeurs de logiciels de dispositifs médicaux et aux testeurs d'assurance qualité. Voici cinq d'entre eux.
- Commencez par l'identification des risques. La première étape de la gestion des risques consiste à identifier les risques potentiels associés au processus de développement de logiciels pour dispositifs médicaux. Cela peut être fait grâce à une analyse approfondie du processus de conception, de développement et de test du logiciel. Les risques potentiels peuvent inclure des dysfonctionnements logiciels, des violations de la sécurité des données et des pannes matérielles.
- Procéder à une évaluation des risques. Une fois les risques identifiés, l'étape suivante consiste à évaluer la gravité et la probabilité de chaque risque. Cela implique de prendre en compte des facteurs tels que la gravité du risque, la probabilité que le risque se produise et ses conséquences potentielles.
- Élaborer des mesures d'atténuation et de contrôle des risques. À ce stade, l'objectif est de développer des stratégies d'atténuation des risques pour réduire ou éliminer les risques identifiés. Cela peut inclure la refonte du logiciel, la mise en œuvre de fonctionnalités de sécurité ou la formation des utilisateurs. Les développeurs pourraient également développer des mesures de contrôle des risques pour minimiser ou éliminer les risques identifiés en prenant des mesures telles que la refonte du logiciel, la mise en œuvre de fonctionnalités de sécurité supplémentaires ou l'élaboration de manuels d'utilisation et de programmes de formation pour l'appareil.
- Surveillez les risques. La surveillance des risques potentiels dans les logiciels de dispositifs médicaux doit être un continuum. Cela signifie que même après la mise en place de stratégies d'atténuation et de contrôle des risques, il est crucial de continuer à surveiller les risques tout au long du cycle de vie du développement logiciel. Cela peut impliquer des tests et une évaluation continus du logiciel pour s'assurer qu'il continue de fonctionner comme prévu et ne pose pas de nouveaux risques.
- Documentez les risques. Il est important de documenter toutes les activités de gestion des risques, y compris les évaluations des risques, les stratégies d'atténuation des risques et la surveillance continue. Cette documentation est essentielle pour démontrer la conformité aux exigences réglementaires et garantir que les risques sont gérés efficacement tout au long du processus de développement logiciel.
Résumé
La gestion des risques est un aspect crucial du développement de logiciels pour dispositifs médicaux. Soumettre les dispositifs médicaux à une analyse statique et dynamique sont deux des meilleurs moyens d'évaluer les risques dans les logiciels de dispositifs médicaux.
Grâce à l'analyse statique et dynamique, les développeurs de logiciels pour dispositifs médicaux peuvent identifier rapidement les risques potentiels, prévenir les dommages aux patients, assurer la conformité réglementaire, gagner du temps et créer des logiciels moins vulnérables aux cyberattaques.
Heureusement, Parasoft propose un ensemble complet de solutions logicielles d'automatisation des tests qui prennent en charge diverses meilleures pratiques pour les tests de dispositifs médicaux dans C / C ++, Javaet .NET applications. Il a été prouvé que ces outils améliorent la sécurité, la fiabilité et l'expérience utilisateur des logiciels de dispositifs médicaux.
Guide de CI/CD pour DevOps de logiciels de dispositifs médicaux
« MISRA », « MISRA C » et le logo triangulaire sont des marques déposées de The MISRA Consortium Limited. ©The MISRA Consortium Limited, 2021. Tous droits réservés.




